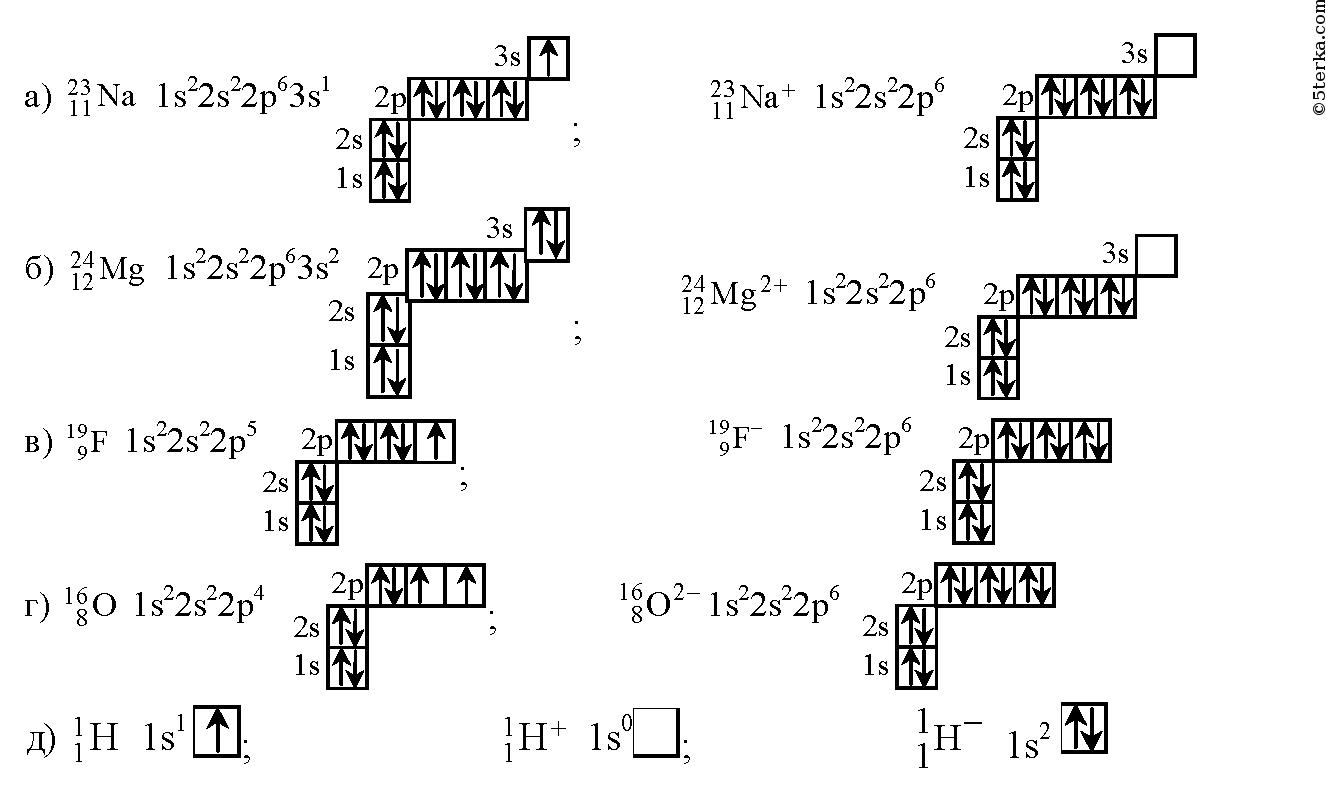
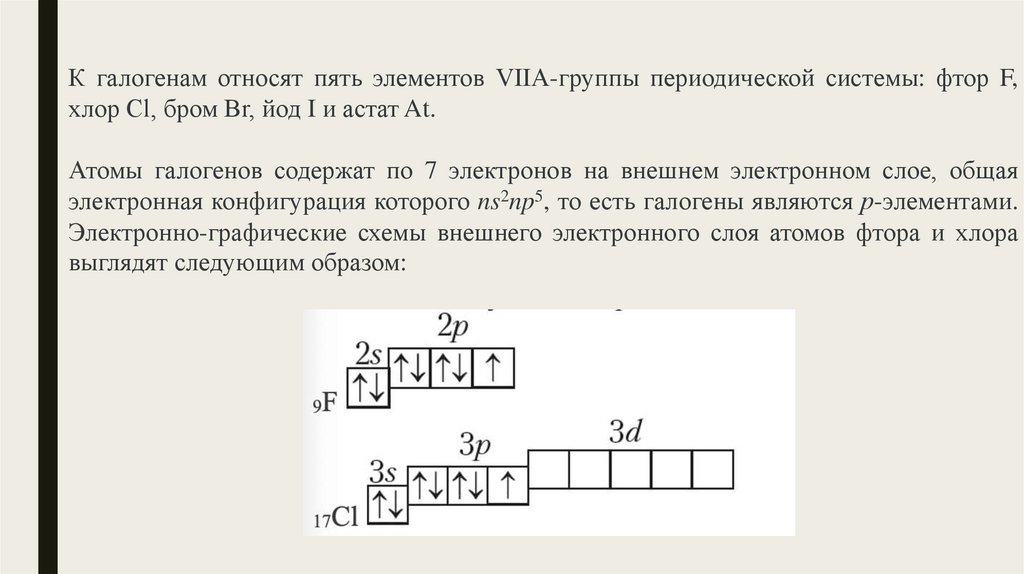
Электронная схема фтора

Информационная система «Электронная структура атомов»
F luorum — химический элемент й группы по устаревшей классификации — главной подгруппы седьмой группы, VIIA второго периода периодической системы химических элементов Д. Менделеева , с атомным номером 9. Является самым химически активным неметаллом и сильнейшим окислителем.






Точечная структура Льюиса дает информацию об электронах внешней оболочки атома. В этой статье обсуждается точечная структура фтора Льюиса, связанная с соединением с различными элементами. Представление символа атома, окруженного электронами самой внешней оболочки, называется структурой точек Льюиса этого атома.
- Содержание
- F 9 Фтор. Фтор — элемент периодической системы химических элементов Д.
- Фтор — элемент главной подгруппы седьмой группы, второго периода периодической системы химических элементов Менделеева, с атомным номером 9. Обозначается символом F Fluorum.
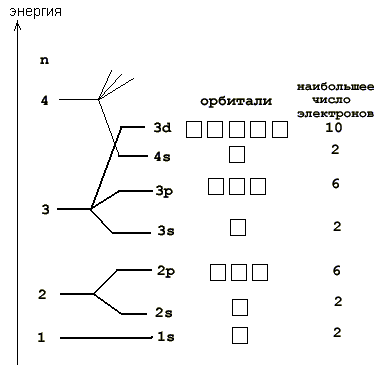
- На этой странице показаны электронные конфигурации нейтральных атомов в их основных состояниях. Для каждого атома подоболочки даны сначала в краткой форме, затем со всеми выписанными подоболочками, за которыми следует число электронов на оболочку.
- Электронные формулы других элементов
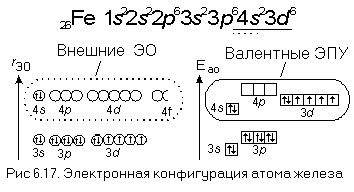
- Электронное строение атома можно показать электронной формулой и электронно-графической схемой. В электронных формулах последовательно записываются энергетические уровни и подуровни в порядке их заполнения и общее число электронов на подуровне.
- При возбуждении p- электрона возникают дублетные и квартетные термы электронных конфигураций 2p 4 nl, которые и формируют спектр атома.
- ОГЭ Химия Задание 2. Строение атома.

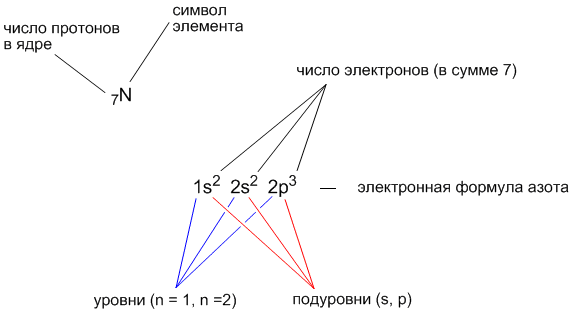
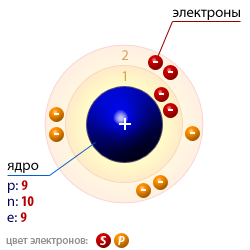


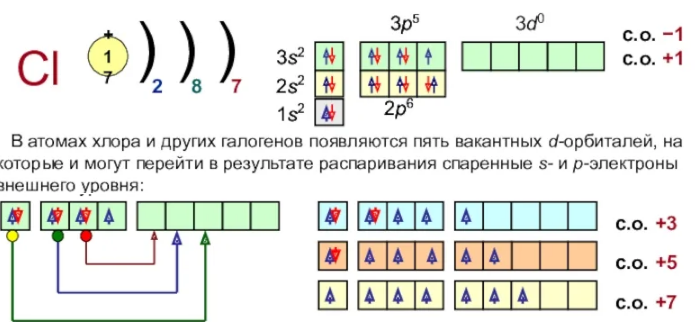
Фтор имеет 9 электронов, заполним электронные оболочки в описанном выше порядке:. Атомы фтора в соединениях имеют степени окисления 0, Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная электроны несут отрицательный заряд , если заряд уменьшается, то степень окисления положительная. Валентность фтора характеризует способность атома F к образованию химических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами.